PCR (polymerasekettingreactie) is een van de in vitro DNA-amplificatietechnologieën, met een geschiedenis van meer dan 30 jaar.
PCR-technologie werd ontwikkeld door Kary Mullis uit Cetus, VS in 1983. Mullis vroeg in 1985 een PCR-octrooi aan en publiceerde in hetzelfde jaar het eerste academische PCR-artikel over wetenschap.Mullis ontving in 1993 de Nobelprijs voor scheikunde voor zijn werk.
Basisprincipes van PCR
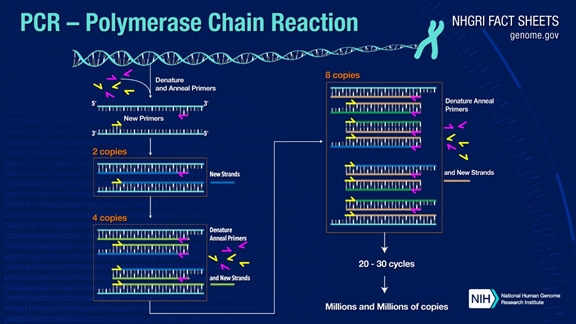
PCR kan doel-DNA-fragmenten meer dan een miljoen keer versterken.Het principe is onder de katalyse van DNA-polymerase, waarbij ouderstreng-DNA als sjabloon en specifieke primer als uitgangspunt voor verlenging wordt gebruikt.Het wordt in vitro gerepliceerd via stappen zoals denaturatie, annealing en verlenging.Het proces van dochterstreng-DNA dat complementair is aan het ouderstreng-template-DNA.
Het standaard PCR-proces is verdeeld in drie stappen:
1.Denaturatie: gebruik hoge temperaturen om dubbele DNA-strengen te scheiden.De waterstofbinding tussen dubbele DNA-strengen wordt verbroken bij hoge temperatuur (93-98 ℃).
2.Anneling: nadat het dubbelstrengs DNA is gescheiden, verlaagt u de temperatuur zodat de primer zich kan binden aan het enkelstrengs DNA.
3. Uitbreiding: het DNA-polymerase begint complementaire strengen te synthetiseren langs de DNA-strengen van de gebonden primers wanneer de temperatuur wordt verlaagd.Wanneer de verlenging is voltooid, is een cyclus voltooid en verdubbelt het aantal DNA-fragmenten
Door deze drie stappen 25-35 keer heen en weer te bewegen, zal het aantal DNA-fragmenten exponentieel toenemen.
Het vernuft van PCR is dat verschillende primers kunnen worden ontworpen voor verschillende doelgenen, zodat fragmenten van doelgenen in korte tijd kunnen worden geamplificeerd.
Tot nu toe kan PCR worden onderverdeeld in drie categorieën, namelijk gewone PCR, fluorescerende kwantitatieve PCR en digitale PCR.
De eerste generatie gewone PCR
Gebruik een gewoon PCR-amplificatie-instrument om het doelgen te versterken en gebruik vervolgens agarosegelelektroforese om het product te detecteren, alleen kwalitatieve analyse kan worden uitgevoerd.
De belangrijkste nadelen van de eerste generatie PCR:
1. Gevoelig voor niet-specifieke versterking en fout-positieve resultaten.
2. De detectie duurt lang en de bediening is omslachtig.
3. Er kan alleen een kwalitatieve test worden uitgevoerd
Realtime PCR van de tweede generatie
Realtime PCR, ook wel qPCR genoemd, maakt gebruik van fluorescerende sondes die de voortgang van het reactiesysteem kunnen aangeven, en bewaakt de accumulatie van geamplificeerde producten door de accumulatie van fluorescentiesignalen, en beoordeelt de resultaten via de fluorescentiecurve.Het kan worden gekwantificeerd met behulp van de Cq-waarde en de standaardcurve.
Omdat de qPCR-technologie wordt uitgevoerd in een gesloten systeem, wordt de kans op besmetting verkleind en kan het fluorescentiesignaal worden gecontroleerd op kwantitatieve detectie, dus het wordt het meest gebruikt in de klinische praktijk en is de dominante technologie in PCR geworden.
De fluorescerende stoffen die worden gebruikt in real-time fluorescerende kwantitatieve PCR kunnen worden onderverdeeld in: TaqMan fluorescerende sonde, moleculaire bakens en fluorescerende kleurstof.
1) TaqMan fluorescerende sonde:
Tijdens PCR-amplificatie wordt een specifieke fluorescerende sonde toegevoegd terwijl een primerpaar wordt toegevoegd.De probe is een oligonucleotide en beide uiteinden zijn gelabeld met een reporter fluorescerende groep en een quencher fluorescerende groep.
Wanneer de sonde intact is, wordt het fluorescerende signaal uitgezonden door de reportergroep geabsorbeerd door de dovende groep;tijdens PCR-amplificatie splitst en degradeert de 5'-3'-exonuclease-activiteit van het Taq-enzym de sonde, waardoor de reporter fluorescerende groep en quencher wordt gemaakt. De fluorescerende groep wordt gescheiden, zodat het fluorescentiebewakingssysteem het fluorescentiesignaal kan ontvangen, dat wil zeggen, elke keer dat een DNA-streng wordt versterkt, wordt een fluorescerend molecuul gevormd en wordt de accumulatie van het fluorescentiesignaal volledig gesynchroniseerd met de vorming van het PCR-product.
2) SYBR fluorescerende kleurstof:
In het PCR-reactiesysteem wordt een overmaat SYBR fluorescerende kleurstof toegevoegd.Nadat de SYBR-fluorescerende kleurstof niet-specifiek is opgenomen in de dubbelstrengs DNA, zendt het een fluorescerend signaal uit.Het SYBR-kleurstofmolecuul dat niet in de keten is opgenomen, zal geen fluorescerend signaal afgeven, waardoor het fluorescerende signaal wordt gegarandeerd. De toename van PCR-producten loopt volledig synchroon met de toename van PCR-producten.SYBR bindt alleen aan dubbelstrengs DNA, dus de smeltcurve kan worden gebruikt om te bepalen of de PCR-reactie specifiek is.
3) Moleculair baken:
Het is een dubbel gelabelde oligonucleotide-probe met stamlus die een haarspeldstructuur vormt van ongeveer 8 basen aan de 5 en 3 uiteinden.De nucleïnezuursequenties aan beide uiteinden zijn complementair gepaard, waardoor de fluorescerende groep en de uitdovende groep strak zijn.Sluiten, er wordt geen fluorescentie geproduceerd.
Nadat het PCR-product is gegenereerd, wordt tijdens het uitgloeiproces het middelste deel van het moleculaire baken gekoppeld aan een specifieke DNA-sequentie en wordt het fluorescerende gen gescheiden van het quencher-gen om fluorescentie te produceren.
De belangrijkste nadelen van PCR van de tweede generatie:
Er is nog steeds geen gevoeligheid en de detectie van exemplaren met weinig kopieën is onnauwkeurig.
Er is de invloed van de achtergrondwaarde en het resultaat is storingsgevoelig.
Als er PCR-remmers in het reactiesysteem zitten, zijn de detectieresultaten gevoelig voor interferentie.
Derde generatie digitale PCR
Digitale PCR (DigitalPCR, dPCR, Dig-PCR) berekent het aantal kopieën van de doelsequentie via eindpuntdetectie en kan nauwkeurige absolute kwantitatieve detectie uitvoeren zonder gebruik te maken van interne controles en standaardcurven.
Digitale PCR maakt gebruik van eindpuntdetectie en is niet afhankelijk van de Ct-waarde (cyclusdrempel), dus de digitale PCR-reactie wordt minder beïnvloed door de versterkingsefficiëntie en de tolerantie voor PCR-reactieremmers wordt verbeterd, met een hoge nauwkeurigheid en reproduceerbaarheid.
Vanwege de kenmerken van hoge gevoeligheid en hoge nauwkeurigheid, wordt het niet gemakkelijk verstoord door PCR-reactieremmers en kan het een echte absolute kwantificering bereiken zonder standaardproducten, wat een hotspot voor onderzoek en toepassing is geworden.
Volgens de verschillende vormen van de reactie-eenheid kan deze worden onderverdeeld in drie hoofdtypen: microfluïdische, chip- en druppelsystemen.
1) Microfluïdische digitale PCR, mdPCR:
Op basis van de microfluïdische technologie wordt de DNA-template gescheiden.De microfluïdische technologie kan de nano-upgrade van het monster of het genereren van kleinere druppeltjes realiseren, maar de druppeltjes hebben een speciale adsorptiemethode nodig en worden vervolgens gecombineerd met het PCR-reactiesysteem.mdPCR is geleidelijk aangenomen door andere methoden te vervangen.
2) Druppelgebaseerde digitale PCR, ddPCR:
Gebruik technologie voor het genereren van water-in-olie-druppels om het monster in druppeltjes te verwerken en verdeel het reactiesysteem dat nucleïnezuurmoleculen bevat in duizenden druppels op nanoschaal, die elk niet het te detecteren nucleïnezuur-doelmolecuul bevatten, of bevat één tot meerdere te testen nucleïnezuur-doelmoleculen.
3) Chipgebaseerde digitale PCR, cdPCR:
Gebruik de geïntegreerde vloeistofbaantechnologie om vele microbuisjes en microholtes op siliciumwafels of kwartsglas te graveren, en regel de stroom van de oplossing door verschillende regelkleppen, en verdeel de monstervloeistof in nanometers van dezelfde grootte in de reactieputten voor digitale PCR-reactie om absolute kwantificering te bereiken.
De belangrijkste nadelen van de derde generatie PCR:
De apparatuur en reagentia zijn duur.
De kwaliteitseisen van de template zijn hoog.Als de sjabloonhoeveelheid de microsysteemhoeveelheid overschrijdt, zal het onmogelijk zijn om te kwantificeren, en als het te klein is, zal de kwantificeringsnauwkeurigheid worden verminderd.
Valse positieven kunnen ook worden gegenereerd wanneer er niet-specifieke amplificatie is.
Posttijd: 30 juli 2021