Het verifiëren van de prestaties van primers en probes in het vroege stadium van PCR-reagentia en het bepalen van de meest geschikte reactieomstandigheden zijn de voorwaarden voor een soepel verloop van formele experimenten.
Dus hoe moeten we de primersonde in een vroeg stadium bevestigen?
De belangrijkste indicatoren zijn baseline, amplificatiecurve, ct-waarde, amplificatie-efficiëntie, monsterdetectie met lage concentratie, CV, enz.
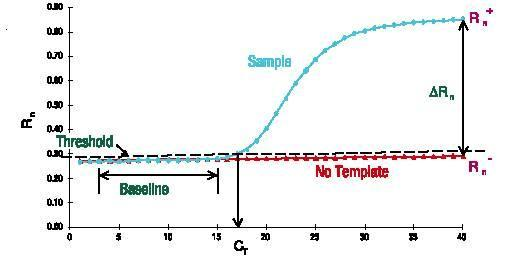
Basislijn
De basislijn is de horizontale lijn in de PCR-amplificatiecurve.In de eerste paar cycli van de PCR-amplificatiereactie verandert het fluorescentiesignaal niet veel en vormt het een rechte lijn.Deze rechte lijn is de basislijn.
Let er bij het screenen van PCR-primerprobes op of de basislijn waterpas is.De zuiverheid van de concentratie van de primersonde zal de basislijn beïnvloeden, zoals ervoor zorgen dat de basislijn stijgt of daalt.De baseline is ook een zeer intuïtieve indicator.
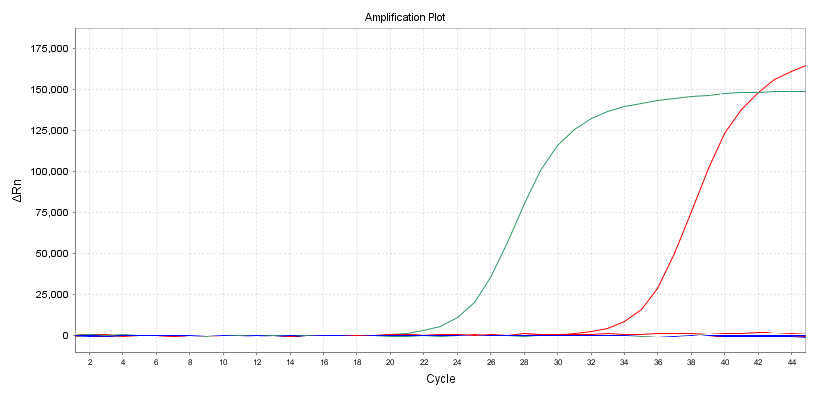
Versterkingscurve
Een andere intuïtieve indicator is de vorm van de versterkingscurve.Het is het beste om een S-vormige curve te hebben om secundaire versterking of andere abnormale versterkingscurven te voorkomen.
Ct-waarde
Het aantal cycli dat overeenkomt met het buigpunt van de basislijn tot de exponentiële groei is de Ct-waarde.
Voor hetzelfde monster resulteren verschillende primerprobes in verschillende amplificatiecurven, en de overeenkomstige Ct-waarde wordt beïnvloed door de amplificatie-efficiëntie en interferentiegraad.In theorie geldt: hoe kleiner de Ct-waarde van de primersonde die we kiezen, hoe beter.
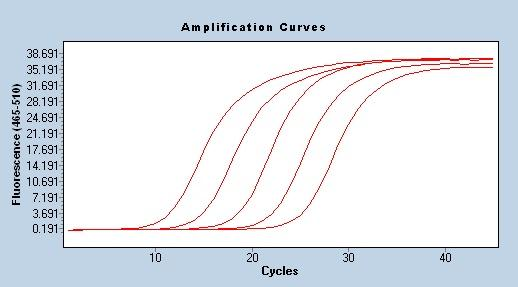
Versterkingsefficiëntie
Een van de meest betrouwbare en stabiele methoden voor het evalueren van de efficiëntie van PCR-amplificatie is de standaardcurve, die ook algemeen wordt erkend door onderzoekers.De methode omvat het maken van een reeks voorbeelden om het relatieve aantal doelsjablonen te controleren.Deze monsters worden meestal gemaakt door seriële verdunningen van geconcentreerde voorraadoplossingen, de meest gebruikte is 10-voudige verdunning.Een reeks verdunde monsters gebruiken, een standaard qPCR-programma gebruiken om te versterken om de Cq-waarde te verkrijgen, en tenslotte een standaardcurve tekenen op basis van de concentratie van elk monster en de overeenkomstige Cq-waarde om de lineaire vergelijking Cq= -klgX0+b te verkrijgen, en de versterkingsefficiëntie E=10(-1 /k)-1.Bij gebruik van qPCR voor kwantitatieve analyse moet de amplificatie-efficiëntie in het bereik van 90%-110% liggen (3,6>k>3,1).
Detectie van monsters met lage concentratie
Wanneer de monsterconcentratie laag is, zijn de detectiepercentages van verschillende primersondes verschillend.We selecteren 20 monsters met een lage concentratie om te repliceren en het primer-sondesysteem met de hoogste detectiegraad is het beste.
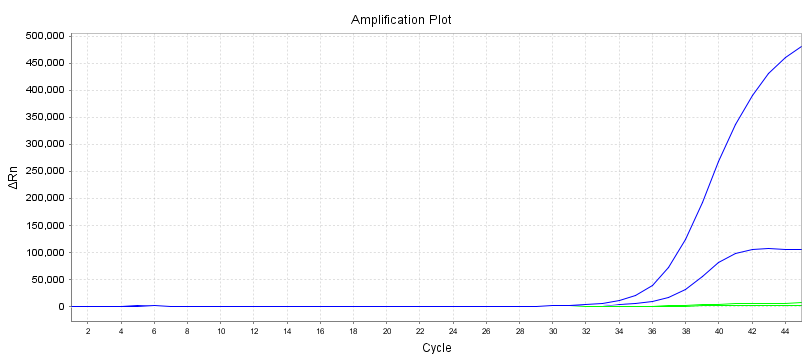
Variatiecoëfficiënt (CV)
Er kunnen 10 duplicaatmonsters worden gedetecteerd met verschillende primerprobes volgens de lijnstandaard van het reagens voor detectie van nucleïnezuuramplificatie.
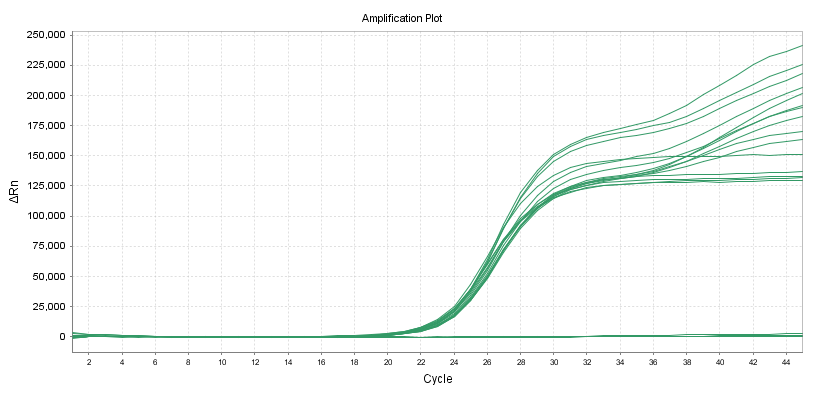
Kwantitatieve reagentia:
Nauwkeurigheid
De nauwkeurigheid binnen één batch moet voldoen aan: de variatiecoëfficiënt (CV,%) van de logaritmische waarde van de testconcentratie is ≤5%.Wanneer de monsterconcentratie laag is, is de variatiecoëfficiënt (CV,%) van de logaritme van de detectieconcentratie ≤10%
Kwalitatieve reagentia:
Nauwkeurigheid
De nauwkeurigheid binnen één batch moet voldoen aan:
(1) Variatiecoëfficiënt van Ct-waarde (CV,%) ≤5%
Hetzelfde monster wordt 10 keer parallel getest en de testresultaten moeten consistent zijn
Posttijd: 18 september 2021








